迈杰医学PD-L1检测试剂盒,达成双适应症伴随诊断
| 导读 | 迈杰医学的PD-L1检测试剂盒(克隆号E1L3N)在多个癌种中均体现出与进口抗体的高度一致性,同时具有相似的药效学数据 |
前言
由迈杰医学自主研发注册生产的PD-L1检测试剂盒(迈谱康®,国械注准20223401300),继非鳞状非小细胞肺癌之后,成功获批第二个适应症,用于辅助鉴别可使用汉斯状®(Serplulimab,斯鲁利单抗注射液)一线治疗的食管鳞状细胞癌患者,达成双适应症伴随诊断。这是该试剂盒从非小细胞肺癌获批、获得专家共识推荐、判读软件获批之后又一重要的里程碑。
从PD-L1临床试验及真实世界的检测来看,有以下值得关注的地方分享给大家。
一、PD-L1的多个克隆号之间表现相近,且药效学相似
从迈谱康的临床试验数据显示:
● 非小细胞肺癌(1033例,其中非鳞状743例)样本中,在阳性阈值TC≥1%时,E1L3N与28-8的比对总符合率达到97.77%;
● 食管鳞癌(1029例)样本中,在阳性阈值CPS≥1时,E1L3N与22C3的比对总符合率达到95.72%;
● 胃癌(794例)样本中,在阳性阈值CPS≥5时,E1L3N与22C3的比对总符合率达到94.71%。
文献中体现多个抗体的染色具有高度一致性:
如下图1显示,E1L3N与22C3、28-8染色表现在同一趋势线下,而如图2显示,E1L3N阳性的人群和22C3阳性人群接受帕博利珠单抗治疗后生存曲线几乎完全重合,体现出不同抗体药效学的相似性。

图1. PD-L1不同克隆号抗体的染色评分表现[1]
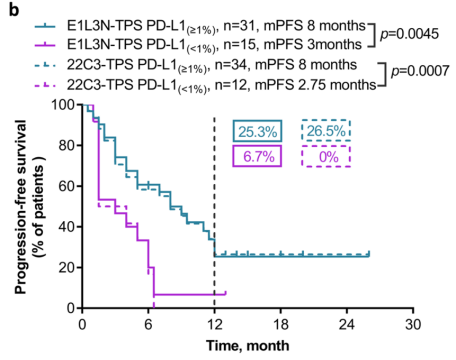
图2. E1L3N与22C3指导帕博利珠单抗的疗效相似性[2]
二、食管鳞癌多中心一致性研究显示,E1L3N的灵敏度更具优势
鉴于先前22C3抗体存在终端不可及等因素,中国医学科学院肿瘤医院牵头发起了食管鳞癌多中心一致性研究,迈杰医学也参与其中。该研究将多款国产抗体与22C3进行一致性比对,Assay4 抗体即为迈杰医学自研的E1L3N。如图3所示,各抗体的染色性能区别并不明显。由图4可知,Assay4 抗体的灵敏度略高,也预示着可以筛选出更多适合治疗的患者。

图3. 参与食管鳞癌PD-L1一致性研究的各抗体染色表现[3]
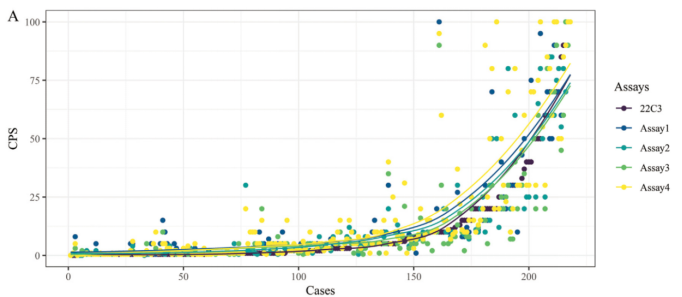
图4. 各抗体CPS评分表现[3]
三、食管鳞癌免疫治疗前检测PD-L1的必要性
目前国内食管鳞癌免疫一线治疗方案多达8种,其中仅斯鲁利单抗联合方案需要限定PD-L1(E1L3N,CPS≥1)阳性人群。那么在真实世界中,这些方案对于PD-L1阴性人群的治疗是否不及预期?我们来看下专家的讨论结果。
去年9月,在美国食品药品管理局(FDA)的肿瘤药物咨询委员会(ODAC)会议上,讨论了对于不可切除或转移性ESCC患者一线使用抗PD-1抗体治疗时,PD-L1表达水平对其风险效益的影响。会议指出,ESCC的治疗批准在先前是不考虑PD-L1状态的,但已有多项试验显示:治疗效果似乎由PD-L1表达水平所影响,在PD-L1≥1的患者中风险效益更显著,而对于PD-L1<1的患者,使用免疫检查点抑制剂可能使其面临毒性风险而无明确的获益潜力(图5)。

图5. FDA关于ESCC进行PD-L1评价的建议
小结
迈杰医学的PD-L1检测试剂盒(克隆号E1L3N)在多个癌种中均体现出与进口抗体的高度一致性,同时具有相似的药效学数据。另外,在食管鳞癌多中心研究中,其凭借和22C3染色高度一致,并具有略高的灵敏度,在众多国产抗体中脱颖而出。目前该试剂盒具备以下特点:
● 双适应症伴随诊断——非鳞状非小细胞肺癌(纳武利尤单抗)、食管鳞状细胞癌(斯鲁利单抗)
● 专家共识推荐——《非小细胞肺癌PD-L1表达临床检测中国专家共识(2023版)》推荐检测抗体
● 多癌种应用——经多中心验证,在胃、头颈、宫颈等癌种与进口抗体高度一致
● 多平台适配——经验证可在Leica及多种国产免疫组化仪器适配使用
● 新适应症注册——胃癌适应症注册中,PD-L1判读软件已上市
参考文献
[1] A Prospective, Multi-institutional, Pathologist-Based Assessment of 4 Immunohistochemistry Assays for PD-L1 Expression in Non-Small Cell Lung Cancer. JAMA Oncol. 2017 Aug 1;3(8):1051-1058.
[2] Validation of E1L3N antibody for PD-L1 detection and prediction of pembrolizumab response in non-small-cell lung cancer. Commun Med (Lond). 2022 Nov 1;2(1):137.
[3] Concordance between four PD-L1 immunohistochemical assays and 22C3 pharmDx assay in esophageal squamous cell carcinoma in a multicenter study. J Natl Cancer Cent. 2023 Nov 30;4(2):162-168.

迈杰转化医学研究(苏州)有限公司(以下简称为:迈杰医学)于2013年成立,前身为QIAGEN转化医学研究中心。作为伴随诊断整体解决方案领导者,拥有综合转化医学技术支持药物临床转化、伴随诊断产品(CDx)开发和用药指导检测三大业务,基于基因组学、蛋白组学、细胞组学,病理组学以及大数据与AI等综合技术平台,一流的产品开发团队与完善的研发流程,以及完善的质量体系(涵盖CAP、CNAS ISO 17025、ISO13485、GMP、GSP等), 迈杰医学围绕靶向治疗,免疫治疗及细胞/基因治疗,赋能药物临床转化研究并开发对应的伴随诊断产品,支持药物上市后的精准用药。迈杰医学已与全球400+创新药企及技术公司展开合作,已开发验证了数百个生物标记物及方法学,支持上百个药物临床试验。截至目前共有20+款产品获得药监批准,涵盖实体肿瘤和血液肿瘤,其中包括国内首个获批的JAK2-V617F突变检测试剂盒及用于免疫治疗的PDL-1检测试剂盒;以及8款CE认证产品。同时,迈杰医学有40多款在研 CDx/IVD产品管线其中有10个正在临床试验中。基于独创的一体化商业模式,迈杰医学已迅速发展成为中国伴随诊断整体解决方案创新企业,解决创新药物的研发痛点及患者的用药痛点,助力精准医疗。
 腾讯登录
腾讯登录


还没有人评论,赶快抢个沙发