STTT | 研究团队首次系统揭示Dysadherin/YAP轴在肝癌干细胞可塑性及免疫逃逸中的关键作用
| 导读 | 靶向Dysadherin(抗黏附素,一种与肿瘤相关的细胞膜糖蛋白,可促进肿瘤转移的发生)可有效抑制肿瘤生长并恢复抗肿瘤免疫应答。 |
12月29日,研究团队在国际知名期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表一项重要研究:首次系统揭示了Dysadherin/YAP轴在肝癌干细胞可塑性及免疫逃逸中的关键作用,为克服晚期肝癌治疗耐药性提供了新策略。该研究通过整合单细胞转录组分析、体外实验及人源化免疫小鼠模型,证实靶向Dysadherin(抗黏附素,一种与肿瘤相关的细胞膜糖蛋白,可促进肿瘤转移的发生)可有效抑制肿瘤生长并恢复抗肿瘤免疫应答。
研究背景:Dysadherin肝癌恶性进展的加速器
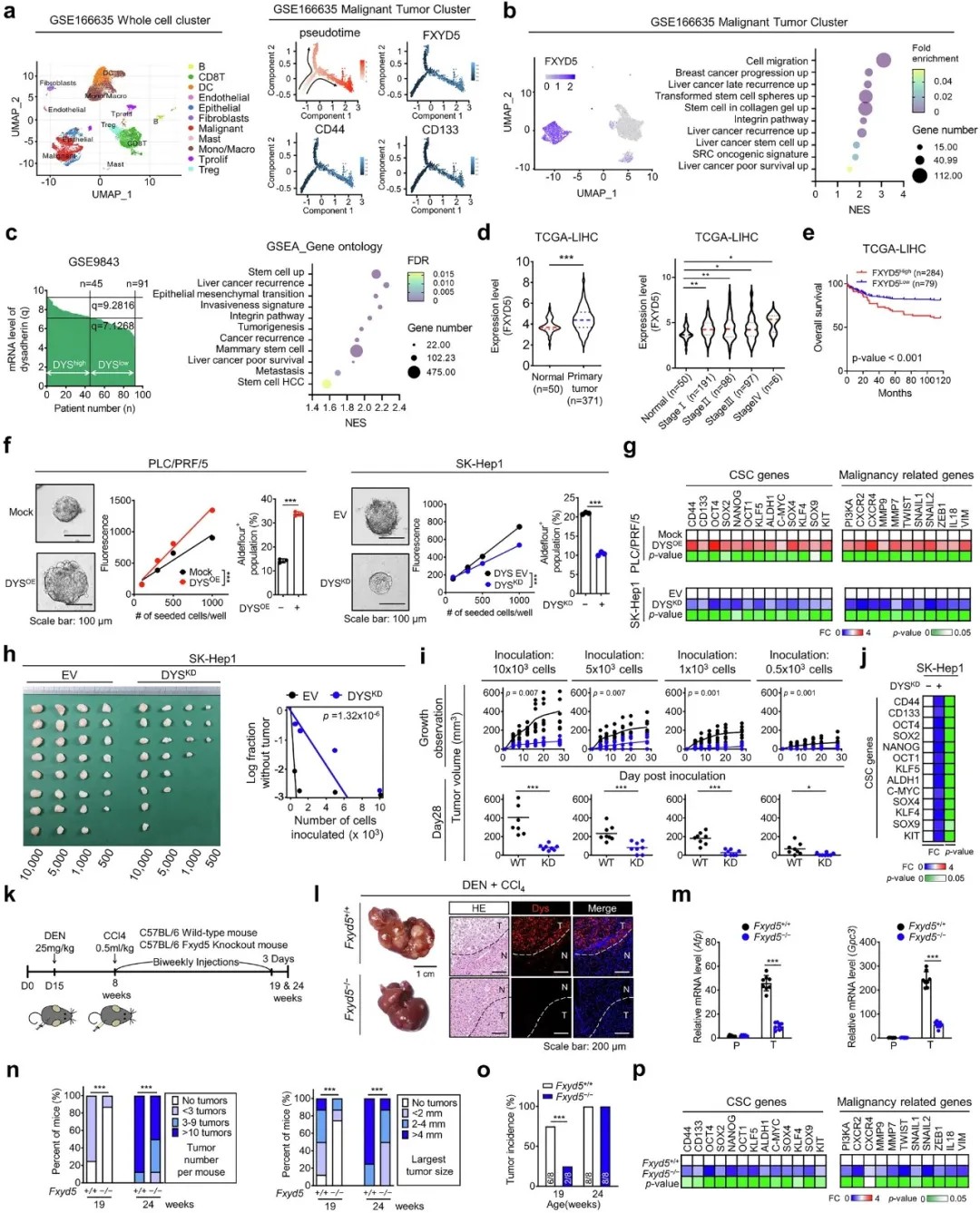
Dysadherin 促进肝细胞癌(HCC)中的癌症干细胞样特征和肿瘤进展
研究团队发现,Dysadherin(由FXYD5基因编码)在肝癌组织中显著高表达,且与肿瘤分级升高、患者预后不良密切相关。单细胞测序数据显示,Dysadherin高表达的肿瘤细胞富集于癌症干细胞(CSC)相关基因签名(如CD133、CD44),并表现出更强的自我更新和转移能力。在动物模型中,敲除Dysadherin可显著减少肿瘤数量和体积,证实其直接驱动肝癌恶性进展
机制解析:Dysadherin通过FAK/YAP/TEAD2轴激活干细胞程序
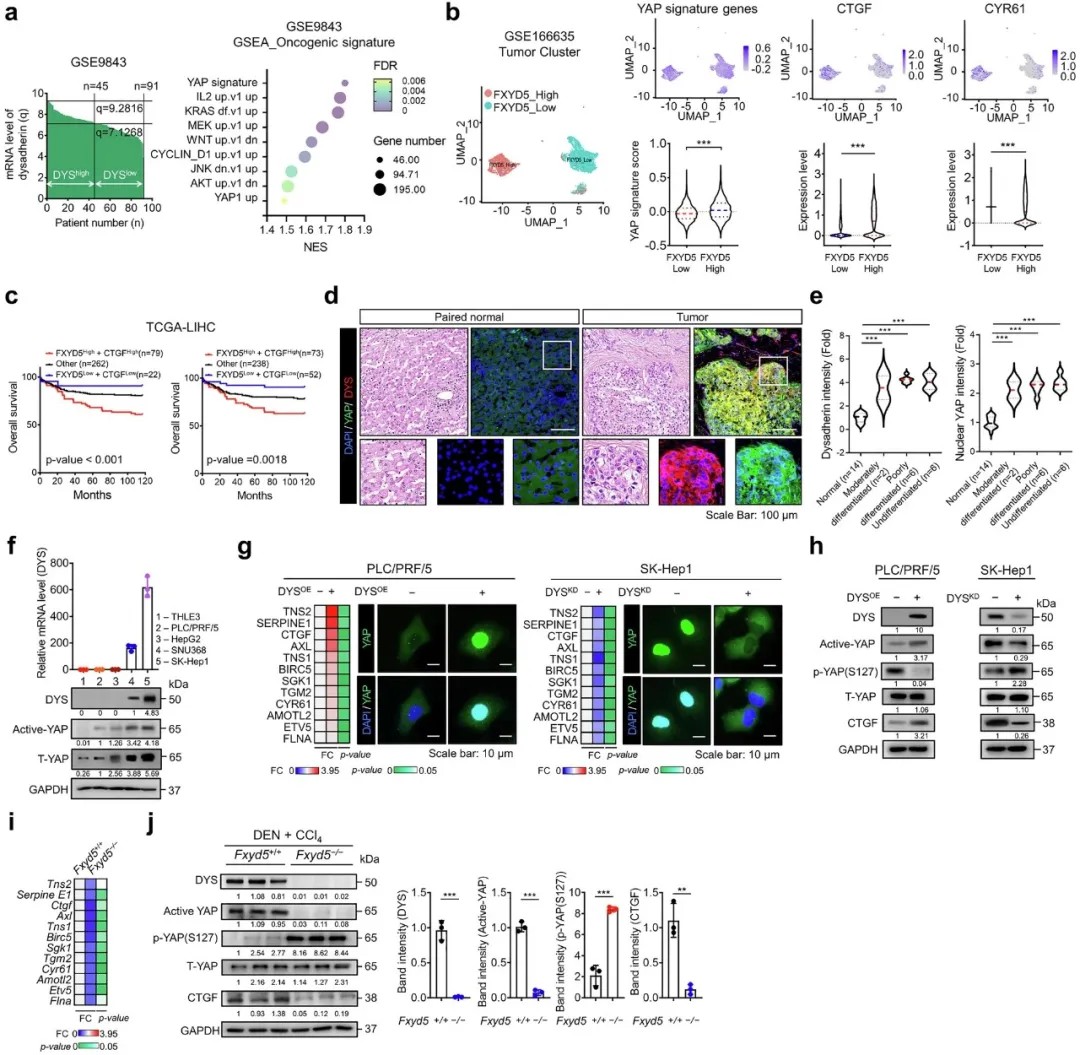
Dysadherin 作为 YAP 信号的上游调控因子,促进肝细胞癌的恶性进展
研究进一步揭示,Dysadherin通过整合素-FAK信号通路抑制Hippo通路核心激酶LATS1/2的磷酸化,导致YAP蛋白去磷酸化并核转位。核内YAP与转录因子TEAD2结合,直接激活OCT4、KLF4等 pluripotency 基因的表达,从而维持肝癌干细胞特性。值得注意的是,TEAD2被证实可直接结合OCT4和PD-L1的启动子区域,同时调控干细胞特性和免疫检查点分子。

在肝细胞癌中,Dysadherin 通过激活 YAP 来促进癌症干细胞(CSC)特征
双重作用:协同驱动化疗耐药与免疫抑制
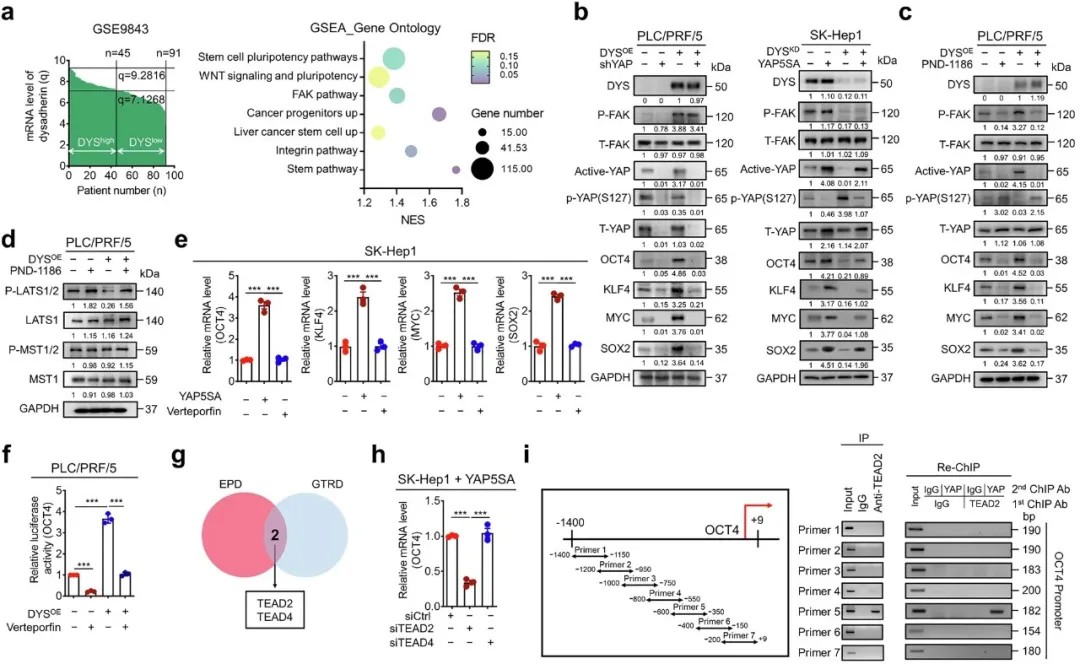
Dysadherin–FAK–YAP 轴在肝细胞癌中驱动 TEAD2 依赖性多能性基因的转录
Dysadherin/YAP轴的激活不仅促进肝癌细胞对索拉非尼等靶向药物的耐药性,还通过上调PD-L1表达诱导T细胞功能衰竭。在人源化小鼠模型中,Dysadherin敲除显著增加肿瘤内CD8⁺ T细胞浸润,并降低PD-1⁺TIM-3⁺耗竭T细胞比例,逆转免疫抑制微环境。空间转录组分析显示,Dysadherin高表达区域与SPP1⁺肿瘤相关巨噬细胞(TAMs)和癌相关成纤维细胞(CAFs)的免疫抑制生态位高度重叠。
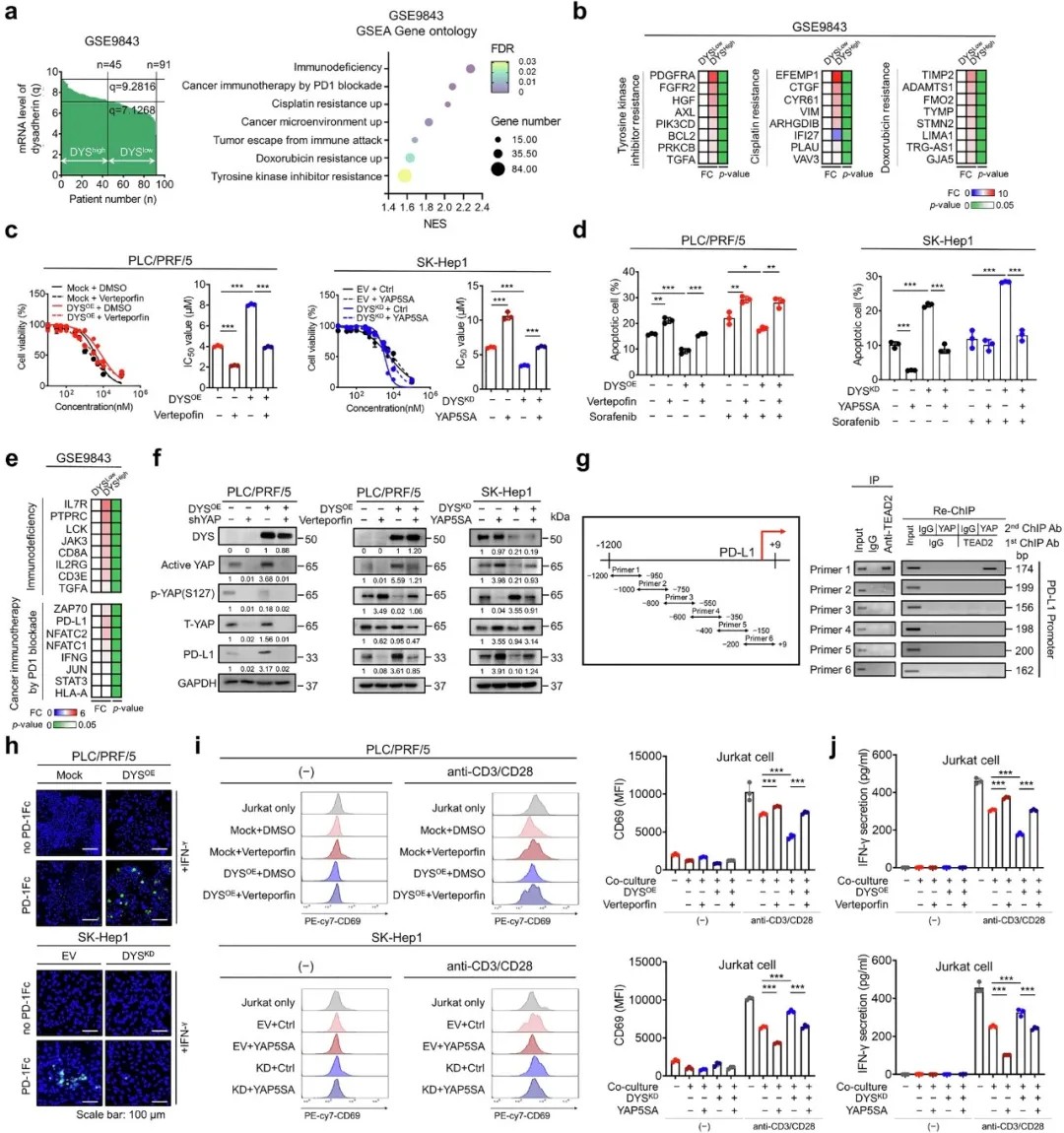
Dysadherin–YAP 轴调节肝细胞癌的耐药性和 PD-L1 介导的免疫逃逸
治疗潜力:靶向肽段抑制Dysadherin/YAP轴
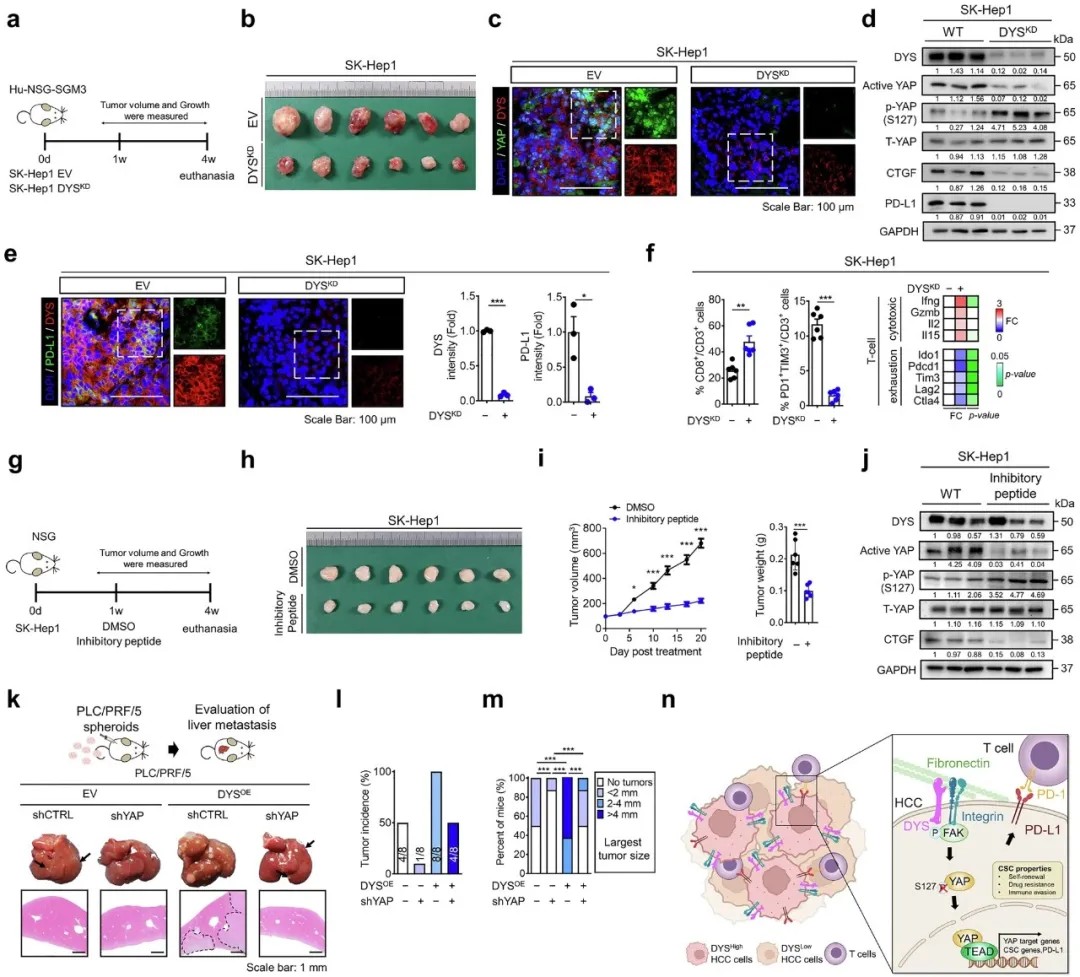
Dysadherin–YAP 轴在体内驱动肝细胞癌进展并促进免疫逃逸
团队设计了一种靶向Dysadherin的多肽抑制剂,可竞争性阻断Dysadherin与整合素的相互作用。在动物模型中,该肽段治疗显著抑制YAP活性和PD-L1表达,减少肿瘤肝转移,且未观察到系统性毒性。这一策略为联合免疫检查点抑制剂或TKI药物提供了新思路,尤其适用于Dysadherin高表达的难治性肝癌患者。
研究意义与未来展望
本研究首次将细胞黏附信号(Dysadherin)与转录调控(YAP-TEAD2)和免疫逃避(PD-L1)联系起来,阐明了肝癌异质性和治疗抵抗的共性机制。未来需进一步验证Dysadherin作为生物标志物在患者分层中的价值,并探索其抑制剂与现有疗法的协同作用。
Dysadherin/YAP轴的发现不仅深化了对肝癌干细胞和免疫微环境的理解,也为突破晚期肝癌治疗瓶颈提供了精准靶点。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41392-025-02520-4
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发